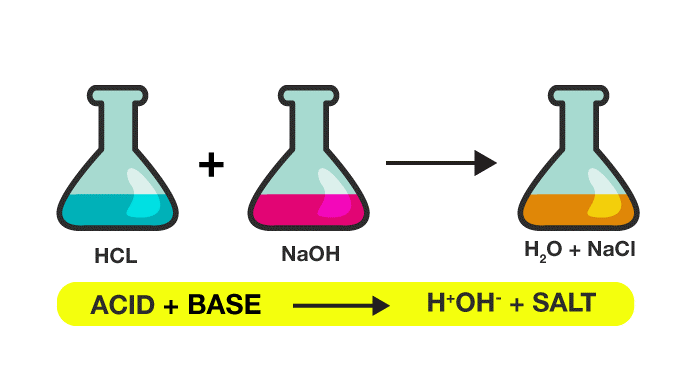
واکنش خنثی شدن در شیمی یکی از مهمترین پدیدههای شیمیایی است که در آن یک ماده اسیدی یا بازی در محیطی با pH مناسب، به تعادل میرسد. به طور دقیقتر، در واکنش خنثی سازی میتوان یک تعادل شیمیایی بین یک اسید و یک باز در نظر گرفت که به شکل زیر نشان داده میشود:
H+ + A- ↔ HA
در این واکنش، H+ نماینده پروتون هست و A- نشان دهنده یک آنیون است و HA نیز نماینده یک مولکول اسیدی است. به عبارت دیگر، در واکنش خنثی شدن، یک پروتون به ماده اسیدی القا میشود و ماده اسیدی به تعادل با ماده بازی در محلول میرسد.
مراحل فرآیند
1. ماده اسیدی و ماده بازی در محلول به تعادل میرسند و در این فرآیند پروتون از ماده اسیدی به ماده بازی منتقل میشود.
2. با افزایش غلظت یا تعداد پروتونهای موجود در محلول، تعادل به سمت ماده اسیدی جابجا میشود و بیشترین تعادل میان اسید و باز در محیطی خنثی شده در دمای و فشار ثابت بدست میآید.
3. در صورت کاهش غلظت یا تعداد پروتونهای موجود در محلول، تعادل به سمت ماده بازی تغییر میکند و تعادل جدید میان اسید و باز در محیطی خنثی شده حاصل میگردد.
به عبارت دیگر، در محیطی خنثی شده، تعادل بین ماده اسیدی و بازی به سمتی جابجا میشود که تعادل بیشتری میان این دو ماده بدست آید.
بررسی عوامل مؤثر بر واکنش، از جمله دما، فشار، pH و …
واکنش خنثی سازی یک واکنش تعادلی است که بستگی به عوامل مختلفی دارد. برخی از این عوامل عبارتند از:
1- pH: همانطور که در تعریف قبلی اشاره شد، pH محیط به شدت روی فرآیند واکنش خنثی شدن تأثیر گذار است. با کاهش pH، غلظت پروتونها افزایش پیدا میکند و بنابراین تعادل، بیشتر به سمت ماده اسیدی جابجا میشود.
2- دما: دما نیز بر واکنش تأثیر گذار است. در دماهای پایین، تعادل آسانتر به سمت ماده بازی جابجا میشود و در دماهای بالا، به سمت ماده اسیدی.
3- فشار: فشار نیز بر تعادل واکنش خنثی سازی تأثیر دارد، اما تأثیر آن در مقایسه با pH و دما کمتر است.
4- نوع ماده اسیدی و بازی: ماده اسیدی و بازی مورد استفاده در واکنش نیز بر روی تعادل تأثیر دارد. این نوع مواد ممکن است به دلایل مختلفی نظیر قدرت اسیدی یا قلیایی بودن، تعادل واکنش را به سمت یکی از آن ها تغییر می دهند.
5- شدت نور: شدت نور نیز بر واکنش تأثیر دارد و ممکن است باعث تغییر در تعادل واکنش شود.
در کل، عوامل مؤثر بر واکنش خنثی سازی بسیار متنوع هستند و هر کدام از این عوامل میتوانند بر تعادل واکنش تأثیر داشته باشند. به همین دلیل، برای انجام این واکنش، بهتر است از شرایط استاندارد و معمول در شیمی استفاده کرد.
مطالعه مثالهایی از واکنش خنثی سازی در شیمی شامل هیدروکسید سدیمپ
واکنش خنثی شدن هیدروکسید سدیم با دی اکسید کربن به صورت زیر است:
NaOH + CO2 → Na2CO3 + H2O
این واکنش در صنایع بزرگ مانند تولید شیشه، صابون و پوششدهی فلزات به کار میرود.
یک مثال دیگر از واکنش خنثی سازی در شیمی، واکنش هیدروکسید آمونیوم با کلرید هیدروژن (HCl) به صورت زیر است:
NH4OH + HCl → NH4Cl + H2O
این واکنش در تولید کود نیتروژنی و نیز به عنوان یکی از روشهای جداسازی کلرید از مخلوط های شیمیایی به کار میرود.
کاربردها
واکنش خنثی شدن در صنایع شیمیایی و فرآیندهای صنعتی مختلف کاربردهای زیادی دارد. در ادامه، برخی از مهمترین کاربردهای این واکنش در صنایع مختلف را مورد بررسی قرار میدهیم:
1- تولید کود: در تولید کود نیتروژنی از واکنش خنثی شدن هیدروکسید آمونیوم با اسیدهای مختلف استفاده میشود.
2- تصفیه آب: واکنش خنثی شدن در تصفیه آب به منظور تعدیل pH آب مورد استفاده قرار میگیرد. در این روش، با استفاده از موادی مانند کربنات کلسیم (CaCO3) یا سدیم (Na2CO3)، pH آب تنظیم میشود.
3- صنایع غذایی: در صنایع غذایی، واکنش خنثی شدن به منظور تعدیل pH محصولات مختلف مانند شیر، پنیر و سسهای غذایی استفاده میشود.
4- صنایع شیمیایی: واکنش خنثی شدن در تولید الکل، چسبهای صنعتی و پلاستیک به منظور تعدیل pH در فرآیندهای تولید استفاده میشود.
5- صنایع نساجی: مورد استفاده در رنگرزی
6- معدنکاری: در معدنکاری برای تعدیل pH محلولهای معدنی به منظور جلوگیری از تشکیل رسوب
در کل، واکنش خنثی شدن در صنایع مختلف به عنوان یکی از مهمترین روشهای تعدیل pH مورد استفاده قرار میگیرد.